はじめに
神経軸索スフェロイド形成を伴う遺伝性びまん性白質脳症(hereditary diffuse leukoencephalopathy with spheroids;
HDLS)は,常染色体優性遺伝を示す稀な若年性認知症疾患である1)2).進行性の認知機能低下に加えて,異常行動,運動障害,てんかん発作など多彩な臨床症状を呈する.2012年,HDLSの原因遺伝子としてコロニー刺激因子1受容体(colony
stimulating factor 1 receptor; CSF1R)が同定3)されて以降,報告が増加している.また,2018年にKonnoらにより診断基準が提唱され,今後さらに増加することが予想される4).今回,軽度のコミュニケーション障害で発症し,約20年の経過で認知機能低下,錐体路ならびに錐体外路症状を呈し,特徴的な頭部画像所見からHDLSと診断した症例を経験したため,文献的考察を含めて報告する.
症例
症例:64歳,女性
主訴:認知機能障害,歩行障害
既往歴:特記事項なし.
家族歴:父親は若い頃に死別し原因は不明.母親は90歳と高齢で健在であるが年齢相応のもの忘れあり.兄は36歳で自殺.姉は交流がなく,詳細不明.子供はいない.
生活歴:特記事項なし.
現病歴:出生や幼少期に問題はなかった.最終学歴は高校卒業.元来,人なつっこく社交的な性格であったが,年齢に比し言動が幼いところがあった.高校卒業後はアルバイトを転々としていた.30歳で結婚し,専業主婦をしていた.結婚当初より洗濯以外の家事は不得手で滞り,部屋は散らかしがちであったが,同居していた母親が主に家事を引き受けていた.40歳頃より独り言がめだつようになり,相手が聞いていなくても,構わずに話を続け,内容もまとまりがなくしゃべっていることがあった.一方で,大勢の人がいるときは話に加わらずに,何を聞かれても黙ってしまい内向的になることもあった.しかし,周囲との関係でトラブルになることはなく,明らかな悪化もみられていなかった.59歳時に夫が亡くなり,一人暮らしを始めた.当初,自立した生活を送れていたものの,次第に部屋にゴミが溜まるようになり,外出することが減り,自宅に引きこもるようになった.その頃より待ち合わせを忘れる,電話にでないといったことを繰り返した.61歳時に部屋の中はゴミがあふれて,風呂にも入らず,尿・便失禁の状態となり,近医精神神経科病院へ医療保護入院した.Mini
Mental State Examination(MMSE)は15点で,頭部CTは脳萎縮と白質病変が認められ,若年性認知症の診断を受けた.その後,介護施設に入所し,健忘から同じことを何度も言うといったことはあったが,日常会話は可能で,独歩で移動し,概ね自立して生活していた.しかし,亡くなった夫が来ている,トイレに人がいるから行けない,男性から覗かれているといった幻覚,妄想がみられた.63歳時に入所者に対し暴力をふるうことがあり,気分の起伏が激しくなった.また,両脚を突っ張った歩行で,転倒が多くなり,車いすを使用するようになった.次第に質問に対してオウム返しをするようになり,会話が成り立たなくなった.64歳時に当院を受診した.
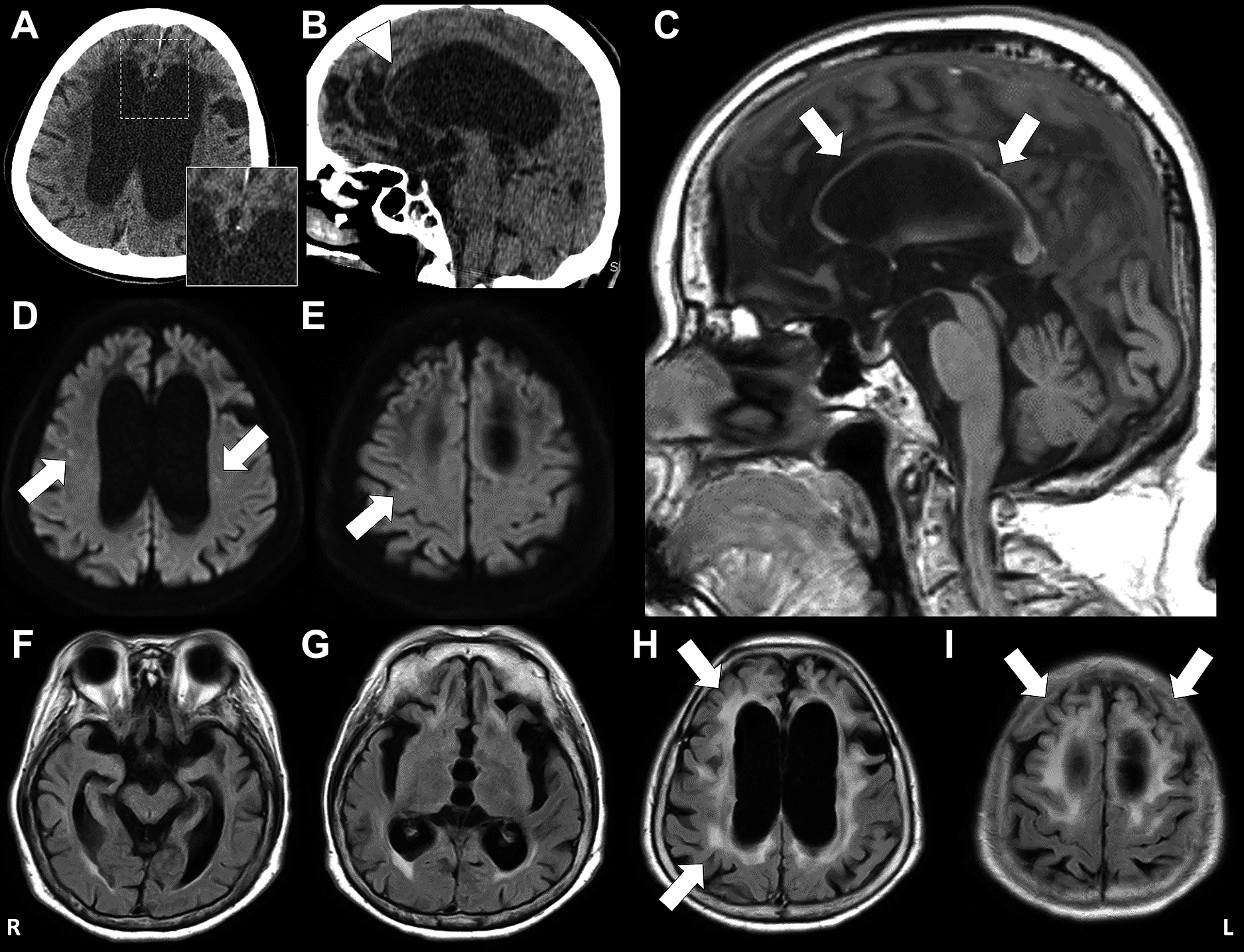
Fig. 1
CT and MR imaging of the brain.
A, B: CT shows calcification in the frontal subcortical white matter (B; arrowhead).
The boxed area is enlarged at the right bottom of the panel. Small spotty calcification
is observed in the affected white matter. C: Sagittal T1-weighted MR images (TR 25 ms, TE 4.6 ms) shows atrophy of the corpus callosum (arrows).
D, E: Diffusion-weighted MR images (TR 3,500 ms, TE 58.3 ms) show multiple hyperintense
lesions in the subcortical and deep white matter (arrows). F–I: FLAIR MR images (TR
11,000 ms, TE 120 ms, TI 2,800 ms) show multiple hyperintense white matter lesions
that are most numerous in the frontal and parietal lobes (H, I; arrows). Cerebral
atrophy with ventricular dilatation is evident.
現症:身長147 cm,体重58 kg.一般身体所見に異常なし.日常生活動作は全介助.神経学的所見では意識は覚醒しているものの,指示動作に従えなかった.言語機能に関して意味のない発語がみられるのみで,言語理解は全くできなかった.自発的動作,随意的動作はほとんどみられなかった.無動,頸部・四肢に強い筋強剛がみられ,起立には介助が必要であり,歩行は小刻みで,すくみ足を認め,非常に不安定であった.四肢の腱反射は亢進し,Babinski反射は陽性,把握反射,吸引反射が認められた.
検査所見:血液検査では,血算および血液生化学所見は正常であった.ビタミンB1,ビタミンB12,葉酸,甲状腺機能は正常で,血清梅毒反応は陰性であった.脳脊髄液検査では,性状は無色透明,細胞数は1/μl以下,蛋白は60 mg/dlと軽度高値であった.MMSE: 0/30点であった.
画像所見:頭部CTは0.5 mm厚で撮像した.両側大脳半球,特に前頭葉優位の皮質下-白質に,ほぼ対称性に低吸収域を認め,側頭葉ならびに前頭葉優位の脳萎縮,脳室の拡大を認めた.また,水平断,矢状断にて前頭葉の側脳室前角に面する白質に微小石灰化像を認めた(Fig. 1A, B).脳MRIはT1強調画像の矢状断にて脳梁の菲薄化を認めた(Fig. 1C).拡散強調画像で両側大脳半球の皮質下白質に点状の高信号が散在し(Fig. 1D, E),FLAIR画像で両側前頭頭頂葉優位にほぼ対称性の高信号の大脳白質病変,大脳の萎縮と顕著な脳室拡大を認めた(Fig. 1F~I).
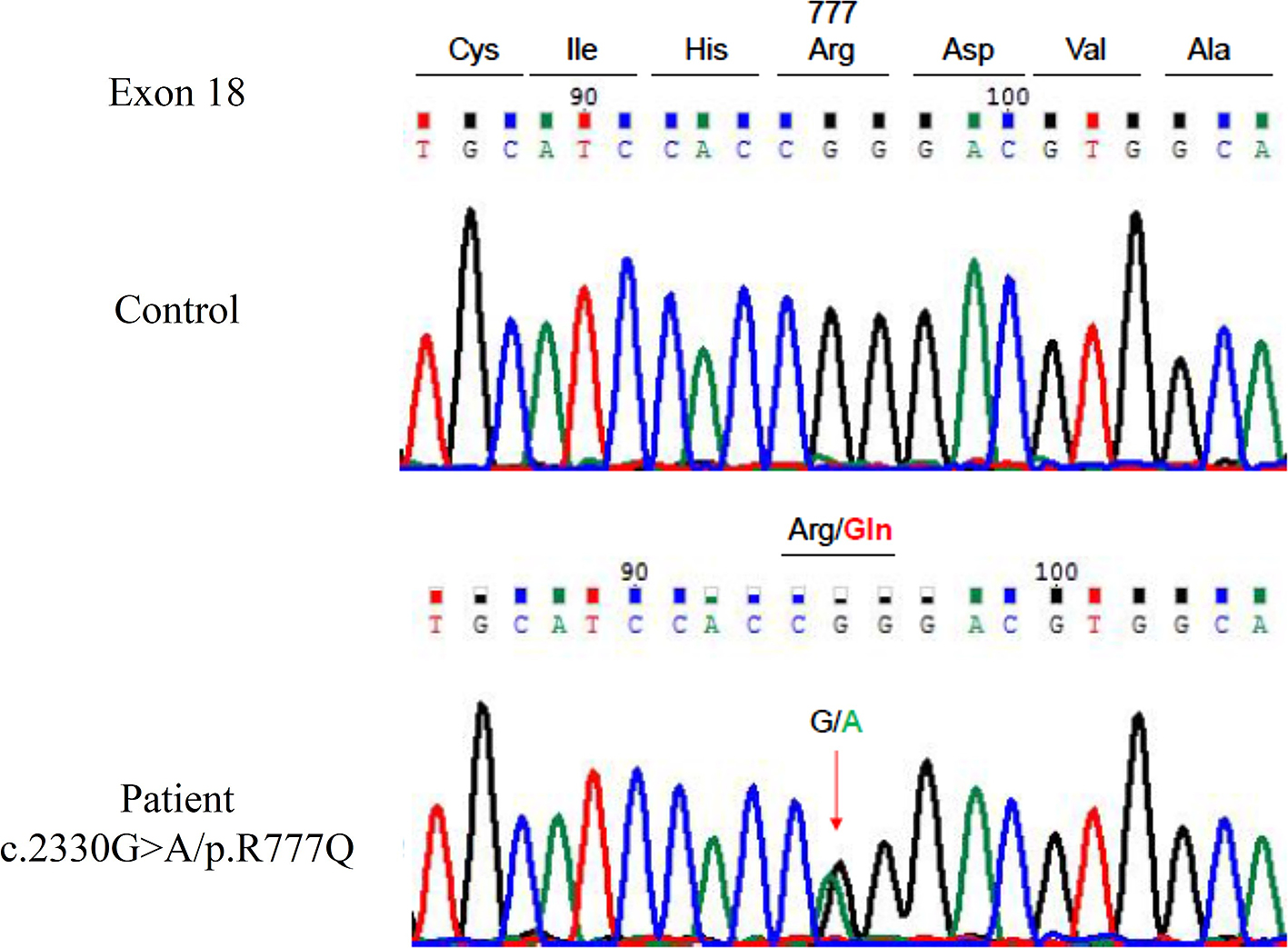
遺伝子解析:臨床症状,頭部画像検査からHDLSを含めた白質脳症の鑑別診断を行い,家族の同意を得てCSF1Rの遺伝子解析を行った結果,exon 18にc.2330G>A/p.R777Qの遺伝子変異を認めた(Fig. 2).
Fig. 2
Genetic analysis.
Genetic analysis reveals a single-base substitution (c.2330G>A) and a p.R777Q in exon
18 of the colony stimulating factor 1 receptor (CSF1R) gene.
考察
HDLSは中枢神経の白質病変をきたす稀な常染色体優性遺伝を示す疾患で,Axelssonらにより1984年に最初に報告された5).2012年にRademakersらによりその原因遺伝子には第5染色体長腕上に存在するCSF1Rが同定され3),最近は孤発例も含めて,世界中で報告が増加している.多くの変異はCSF1Rのチロシンキナーゼ領域(exon 12~21)に存在し,本症例もexon 18に既報と同じミスセンス変異(c.2330G>A/p.R777Q)を認めた.
臨床症候は多彩で,性格変化や抑うつなどの精神症状,認知機能障害,パーキンソン症状,前頭葉機能障害,歩行障害などがみられる.Konnoらの報告では,初発症状は認知機能低下59%,精神症状44%,運動障害38%であった6).初発症状としての認知機能障害は40歳前後でみられ,精神症状や運動障害は経過中もしくは初発症状として出現すると考えられている.本症例は40歳頃からの独語やコミュニケーション障害を家族が認識しており,この軽度の精神症状を初発症状と判断した.しかし,その後長期にわたり生活に支障をきたすことは少なく,日常生活に支障のある認知機能低下をきたすまで約20年を要した.一旦急速な認知機能低下を呈し始めて約5年の経過で運動症状の増悪をきたし車いす生活に至った.このように本症例の特徴である軽微な精神症状から始まり長期期間経過後に,亜急性の増悪を呈した臨床経過はこれまでの報告ではみられない.HDLSの発症には,先天的にミクログリアの減少や形態異常があり,異常なミクログリアが潜在的に脳内で蓄積することによって,脳白質変性をきたす.そして,加齢に伴い,多くは40~50歳代となると,臨床症状が出現し,その後急速に進行するとされている7).その急速な進行には免疫反応や肉体的,精神的なストレスといったイベントが関わる可能性がある.本症例では,身体的・精神的な平衡状態が保たれていたが,夫との死別や一人暮らしを始めるといったイベントが引き金になり,臨床的に急速な進行に転じた可能性があると考えられた.また,HDLSにおいて遺伝子型と表現型の相関に関する検討は十分ではなく,本症例と同変異の既報例においても,類似の先行する精神症状はみられなかった8)~12).
HDLSの画像的特徴として頭部CTによる微小石灰化像が言われている13).特に矢状断による脳梁外側に飛び石状(stepping stone appearance)は診断的価値が高いとされる.本症例では,頭部CTを複数回撮像されていたものの,0.5 mm厚のスライスで撮像して初めて前頭葉白質に1箇所の石灰化像を確認することができた.また,脳MRIでは,Konnoらの報告によると両側大脳白質病変69%,大脳皮質萎縮64%,側脳室の拡大57%,脳梁の菲薄化49%に認められる6).本症例においてもこれら特徴的な所見を有し,診断への手がかりとなった.
HDLSには現在根本的な治療法はなく,症状に応じた対症療法が行われる.認知症を呈して6年以内に死亡することが多く,予後は不良と判断される.常染色体優性遺伝と言われているが,孤発性も多数報告されており,本症例も明らかな家族歴はなかった.若年性認知症の鑑別において,HDLSは多彩な臨床症候を呈したり,長期に軽微な精神症状を呈することがあり,家族歴の有無に関わらず,画像検査とともに疑わしい場合は,遺伝子診断を積極的に行うことは生命予後を考える上でも重要であると思われる.
Notes
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.
文献
今野卓哉,他田正義,他田真理ら.軸索スフェロイド形成を伴う遺伝性びまん性白質脳症(HDLS)とCSF-1遺伝子変異.Brain Nerve 2014;66:581-590.
玉岡晃.神経軸索スフェロイド形成を伴う遺伝性びまん性白質脳症(HDLS).Brain Nerve 2017;69:17-23.
Rademakers R, Baker M, Nicholson AM, et al. Mutations in the colony stimulating factor
1 receptor (CSF1R) gene cause hereditary diffuse leukoencephalopathy with spheroids.
Nat Genet 2011;44:200-205.
Konno T, Yoshida K, Mizuta I, et al. Diagnostic criteria for adult-onset leukoencephalopathy
with axonal spheroids and pigmented glia due to CSF1R mutation. Eur J Neurol 2018;25:142-147.
Axelsson R, Röyttä M, Sourander P, et al. Hereditary diffuse leukoencephalopathy with
spheroids. Acta Psychiatr Scand Suppl 1984;314:1-65.
Konno T, Yoshida K, Mizuno T, et al. Clinical and genetic characterization of adult-onset
leukoencephalopathy with axonal spheroids and pigmented glia associated with CSF1R
mutation. Eur J Neurol 2017;24:37-45.
Konno T, Kasanuki K, Ikeuchi T, et al. CSF1R-related leukoencephalopathy: a major
player in primary microgliopathies. Neurology 2018;91:1092-1104.
Karle KN, Biskup S, Schüle R, et al. De novo mutations in hereditary diffuse leukoencephalopathy
with axonal spheroids (HDLS). Neurology 2013;81:2039-2044.
Guerreiro R, Kara E, Le Ber I, et al. Genetic analysis of inherited leukodystrophies:
genotype-phenotype correlations in the CSF1R gene. JAMA Neurol 2013;70:875-882.
Hoffmann S, Murrell J, Harms L, et al. Enlarging the nosological spectrum of hereditary
diffuse leukoencephalopathy with axonal spheroids (HDLS). Brain Pathol 2014;24:452-458.
Codjia P, Ayrignac X, Mochel F, et al. Adult-onset leukoencephalopathy with axonal
spheroids and pigmented glia: an MRI study of 16 french cases. AJNR Am J Neuroradiol
2018;39:1657-1661.
Makary MS, Awan U, Kisanuki YY, et al. Adult-onset leukoencephalopathy with axonal
spheroids and pigmented glia: Clinical and imaging characteristics. Neuroradiol J
2019;32:139-142.
Konno T, Broderick DF, Mezaki N, et al. Diagnostic value of brain calcifications in
adult-onset leukoencephalopathy with axonal spheroids and pigmented glia. AJNR Am
J Neuroradiol 2017;38:77-83.

